Calendrier scientifique Avril 2019
La lutte contre le paludisme commence par le diagnostic.
Comment la détection directe et automatisée des globules rouges (GR) infectés par le paludisme contribue-t-elle à la lutte mondiale menée contre la maladie?
Le paludisme peut toujours être écarté si un test de diagnostic rapide (TDR) de paludisme extrêmement sensible est négatif
Si l'on n’observe aucun GR infecté par le paludisme au cours de l’étude microscopique optique d'un frottis de sang périphérique appartenant à un patient fébrile, on peut supposer que la cause de la fièvre n’est pas d'origine paludique
La technologie automatisée XN-31 permet une quantification rapide, exacte et précise des GR infectés par le paludisme, facilitant ainsi la surveillance de la diminution de la charge parasitaire et par conséquent l’efficacité thérapeutique, une fois que le traitement basé sur des médicaments antipaludiques a débuté
Les TDR du paludisme peuvent être utilisés efficacement pour surveiller la réponse aux médicaments antipaludiques
Congratulations!
That's the correct answer!
Sorry! That´s not completely correct!
Please try again
Sorry! That's not the correct answer!
Please try again
Notice
Please select at least one answer
Informations scientifiques
Le paludisme reste l’une des préoccupations de santé publique les plus importantes au monde avec plus de 3,2 milliards de personnes exposées à un risque d'infection dans 91 pays[1]. Le Rapport sur le paludisme dans le monde 2017 de l’OMS démontre qu'après une période remarquable de succès dans le contrôle du paludisme à l’échelle internationale, le nombre de cas a à nouveau augmenté et les progrès se sont arrêtés. Tous les efforts seront les bienvenus pour renverser cette tendance, chaque cas de paludisme évité et chaque décès écarté renforçant le mouvement mondial vers l’éradication.
Un diagnostic précoce et exact constitue un aspect essentiel des efforts à consentir pour contrôler le paludisme. L’OMS recommande la mise en œuvre d'un test parasitologique pour tous les cas suspectés de paludisme, sous la forme d'un TDR ou d'un test microscopique, dans le but d'éviter tout traitement présomptif fondé sur la seule suspicion clinique et de réduire l’exposition inutile à des médicaments antipaludiques.
Actuelle norme de référence en matière de diagnostic, l'évaluation microscopique d'un frottis de sang périphérique permet une visualisation directe des parasites dans les globules rouges infectés. Toutefois, cette évaluation est très subjective, car la limite de détection est fortement influencée par le niveau de compétence et de soin du microscopiste. Par conséquent, une infection de paludisme de faible densité et d'échelle inframicroscopique passera souvent inaperçue dans la pratique de routine, les femmes enceintes étant affectées de manière disproportionnée. À cela s'ajoute le fait qu'un paludisme non diagnostiqué en cas de grossesse présente un risque élevé de mortalité pour la mère et le fœtus.
D'autre part, les tests de diagnostic rapides (TDR) par immunochromatographie sont faciles à utiliser et par conséquent largement déployés en tant que tests autonomes ou compléments à la microscopie. Les TDR se fondent sur la détection indirecte du paludisme basée sur la présence d'un antigène ou d'une protéine du paludisme[2]. Toutefois, il existe certains inconvénients aux TDR : ils ne permettent pas de distinguer une infection aiguë d'une infection traitée récemment ; ils ne sont pas quantitatifs et dès lors, ils ne peuvent être utilisés pour contrôler l’efficacité du traitement ; tous les TDR ne permettent pas de détecter toutes les espèces de Plasmodium ; en outre, ils manquent de spécificité (réactivité croisée à d'autres antigènes, p. ex. le facteur rhumatoïde) et de sensibilité (par rapport à une microscopie spécialisée). Dans la perspective de l’augmentation des cas d'infection à faible densité à mesure que des progrès sont réalisés dans le contrôle du paludisme et que les pays avancent vers l’éradication de la maladie, des TDR extrêmement sensibles ont été développés avec comme antigène cible la protéine riche en histidine II (HRP2) du P. falciparum. Malheureusement, l'avantage escompté de la sensibilité accrue a été atténué par la découverte de mutations de l'antigène HRP2 dans le P. falciparum, le parasite du paludisme le plus répandu et le plus mortel. Par conséquent, tout TDR basé sur le HRP2 deviendra moins efficace à mesure que ces mutations se propageront.
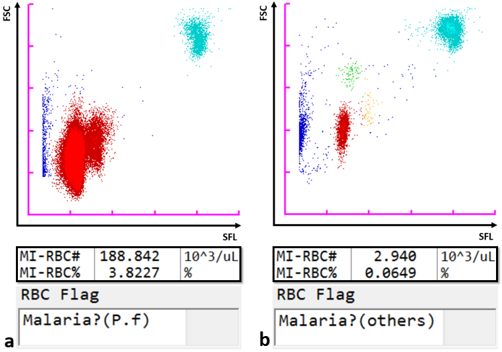
Grâce à son laser semi-conducteur doté d'un faisceau de 405 nm qui permet la détection de particules plus petites, l’analyseur automatisé d’hématologie Sysmex XN-31 peut détecter et compter les globules rouges infectés par le paludisme (MI-RBC) en plus des paramètres standard de formule sanguine complète en recourant au principe de la fluorocytométrie en flux. Les globules rouges sont en partie perméables, de sorte qu'ils peuvent absorber un marqueur de fluorescence qui colore les acides nucléiques des parasites du paludisme dans les cellules infectées. L’intensité de la fluorescence à diffusion latérale (SFL) et le signal de diffusion frontale de la lumière (FSC) sont représentés graphiquement pour générer un scattergramme du paludisme (P). La taille des GR infectés et la teneur en acide nucléique susceptible d’être colorée augmentent à mesure que des anneaux se développent progressivement à partir des trophozoïtes et des schizontes durant le cycle de vie asexué. De façon similaire, on distingue sans aucune ambiguïté les gamétocytes qui se forment à la suite d'une impulsion développementale vers la reproduction sexuée. Ainsi, le XN-31 classe les infections de paludisme dans un échantillon en fonction de la phase du cycle de vie sur la base de la SFL qui reflète la quantité d'acide nucléique, et de la FSC qui reflète la taille des MI-RBC. Les schémas de scattergramme diffèrent d'une espèce de Plasmodia à l'autre, la distinction permettant au logiciel de l'analyseur de donner une indication relative à l’espèce probable (P. falciparum ou autre).
L'analyseur présente une limite inférieure de détection de 20 parasites/μL, bien plus basse que celle des TDR classiques et de la microscopie des frottis en routine (≥100 parasites/μL [3]).
L'analyseur XN-31 est un outil idéal permettant une reconnaissance précise et une énumération automatique et rapide de la parasitémie du paludisme, indépendamment des compétences de l'opérateur ou de l’espèce impliquée. Il détecte le parasite en tant que tel et aucun produit dérivé tel que des antigènes, de l’hémozoïne ou des parasites phagocytosés dans les globules blancs, ce qui le rend beaucoup plus adapté à la détection du paludisme que les TDR et d'autres méthodes automatiques indirectes [4]. De plus, la mesure en parallèle d'une formule sanguine complète constitue un moyen unique de fournir des données précieuses utiles à la corrélation clinique.
Scattergrammes
Résultats d'analyse, y compris les scattergrammes, les valeurs des MI-RBC et les alertes relatives aux GR pour les échantillons de patients infectés par a) P. falciparum (P.f) et b) P. ovale (autres). Les parasites P. ovale ont été confirmés au microscope.
Légende :
SFL : fluorescence à diffusion latérale ; FSC : signal de diffusion frontale ; points bleus : GR, plaquettes et débris non infectés ; points rouges : MI-RBC ; points verts et orange : différentes formes de cycle de vie de P. ovale ; points turquoise : globules blancs
Références
- WHO. World malaria report 2018. Geneva: World Health Organization; 2018. www.who.int/malaria/publications/world-malaria-report-2018/en/.
- Chotivanich K, Silamut K, Day N. Laboratory diagnosis of malaria infection ‒ A short review of methods. N Z J Med Lab Sci. 2007; 61:4-7.
- WHO. Policy brief on malaria diagnostics in low transmission settings. Geneva: World Health Organisation; 2014. https://www.who.int/malaria/publications/atoz/malaria-diagnosis-low-transmission-settings-sep2014.pdf?ua=1
- Pillay E, Khodaiji S, Bezuidenhout BC, Litshie M, Coetzer TL. Evaluation of automated malaria diagnosis using the Sysmex XN-30 analyser in a clinical setting. Malar J. 2019; Jan 22; 18(1):15. doi: 10.1186/s12936-019-2655-8.