Calendrier scientifique - septembre 2022
Transformation d’un lymphome folliculaire (FL) en leucémie lymphoïde B aiguë (B-ALL)
Comment les transformations de leucémies complexes peuvent-elles être identifiées facilement ?
En évaluant la formule sanguine complète et l’information morphologique
En utilisant uniquement l’anamnèse et les symptômes du patient
En utilisant une combinaison de morphologie et d’immunophénotypage
Congratulations!
That's the correct answer!
Sorry! That´s not completely correct!
Please try again
Sorry! That's not the correct answer!
Please try again
Notice
Please select at least one answer
Contexte scientifique
Le lymphome folliculaire (FL) est la forme la plus commune du lymphome indolent dans le monde occidental et représente environ 25 % des lymphomes malins [1]. La progression de la maladie du FL est souvent imprévisible, avec une progression de 25 % à 30 % des cas de FL – généralement en un lymphome diffus à grandes cellules B, un lymphome de Hodgkin, un lymphome de Burkitt et, plus rarement, un lymphome ou une leucémie lymphoïde B (B-ALL) [2]. Ce phénomène conduit à un pronostic très défavorable, avec une espérance de vie d’environ dix mois après le diagnostic [3]. La détection de la progression de la maladie est par conséquent essentielle.
Une cytométrie en flux peut être utilisée pour détecter la progression d’un FL en une B-ALL. La détection dépend de la capacité de la cytométrie en flux à différentier les deux populations de cellules malignes.
Contexte d’un cas
Un patient avec un FL connu se présente à nouveau avec une masse dans les ganglions lymphatiques de l’aine droite et de l’aisselle droite. Une formule sanguine complète est réalisée et les résultats montrent un faible taux d’hémoglobine avec une fusion des populations de lymphocytes et de monocytes.
Un frottis sanguin est effectué et des blastes ainsi que des lymphocytes à noyaux clivés sont observés. Les résultats morphologiques mènent à conclure qu’un immunophénotypage sur un aspirat de moelle osseuse est requis.
L’immunophénotypage est réalisé avec le cytomètre en flux disponible au laboratoire. Les résultats montrent l’expression de blastes et de lymphocytes B matures avec un diagnostic général de transformation de FL en B-ALL. L’échantillon est ensuite évalué sur un cytomètre en flux Sysmex ; les résultats s’avèrent comparables à la prédiction.
Ce cas démontre les avantages de la cytométrie en flux pour le diagnostic de cas complexes. Il souligne aussi l’importance de l’inclusion d’états pathologiques complexes lors de l’évaluation d’une nouvelle instrumentation pour garantir une détection fiable de populations multiples.
Ces résultats ont été décrits dans une affiche scientifique [4].
Interprétation morphologique
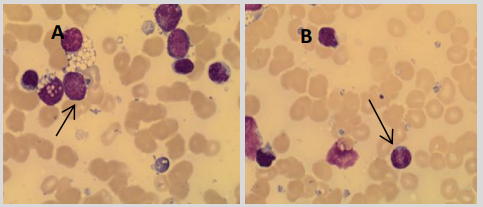
L’aspirat de moelle osseuse du patient est examiné et révèle une population de lymphocytes et de blastes anormaux, tel que représenté sur la figure 1.
Interprétation des données d’immunophénotypage
L’immunophénotypage est réalisé avec les anticorps suivants : CD3, CD7, CD10, CD13, CD14, CD15, CD16, CD19, CD20, CD22, CD33, CD34, CD38, CD45, CD117 et HLA-DR. Une expression d’antigène cytoplasmique a aussi été déterminée pour les antigènes suivants : CD3, CD22, CD79a, MPO et TDT. L’acquisition des données a été effectuée sur un BD FACSCanto II et sur le Sysmex XF-1600 avec 20 000 cellules acquises pour chaque tube. L’analyse des données a été exécutée avec le logiciel BD FACSDiva et le logiciel Sysmex XF-1600.
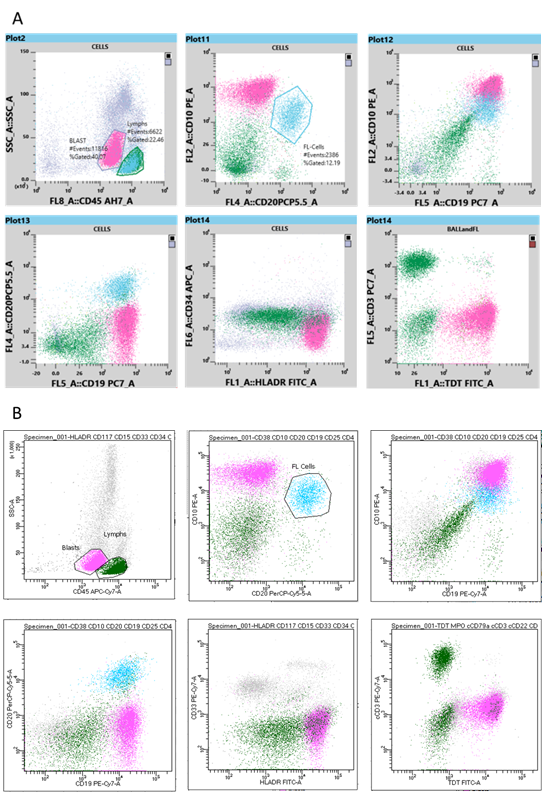
Les populations d’intérêt (lymphocytes et blastes) ont été classées en fonction de leurs caractéristiques SSC et CD45, ce qui permet de déterminer leur motif d’expression antigénique et leur SI. En outre, la population positive double CD20 et CD10 a été classée pour identifier les cellules FL. Les cellules FL classées sont représentées sur les graphiques suivants : SSCvCD45, CD10vCD20, CD10vCD19 et CD20vCD19. Les résultats des deux cytomètres en flux ont été comparés.
L’analyse de l’immunophénotypage sur les deux cytomètres en flux a permis l’identification d’une population de blastes exprimant les antigènes CD19, HLA-DR, TdT (SI modéré), CD10 (SI fort) et CD45 (SI faible). Ces cellules ne présentaient cependant pas d’expression de CD20. Cet immunophénotype répond aux critères de l’Organisation mondiale de la santé (OMS) pour la leucémie B-ALL [2]. En outre, les deux cytomètres en flux ont permis une identification simultanée d’une population de lymphocytes B matures qui ont exprimé CD20, CD19, CD10 (SI modéré) et CD45 (SI fort), mais ne montrent pas une expression de l’antigène TdT – un immunophénotype correspondant au FL diagnostiqué antérieurement. Les graphiques à points du Sysmex XF-1600 et du BD FACSCanto II sont affichés respectivement sur les figures 2A et 2B.
Les deux cytomètres en flux ont permis la détection de deux populations de cellules malignes : la population de cellules B malignes du FL diagnostiqué antérieurement et la nouvelle population de blastes de la leucémie B-ALL. Les résultats d’immunophénotypage produits par le BD FACSCanto II et le Sysmex XF-1600 sont comparables en ce qui concerne le motif de l’expression antigénique et l’intensité de la coloration.
Références
[1] Ciobanu A, Stanca O, Triantafyllidis I, and Lupu A. (2013): Indolent Lymphoma: Diagnosis and Prognosis in Medical Practice. Maedica; 8(4): 338–342.
[2] Swerdlow S et al. (2017): WHO Classification Of Tumours Of Haematopoetic And Lymphoid Tissues. 4th ed. Lyon: IARC, pp. 266–268.
[3] Morley NJ, Evans LS, Goepel J, and Hancock BW. (2008): Transformed follicular lymphoma: The 25-year experience of a UK provincial lymphoma treatment centre.
[4] Woodhead L and Stevens M. Haematology Department, Royal Hallamshire Hospital, Sheffield Teaching Hospitals NHS Foundation Trust. (2021): Comparing antibody expression and staining intensity between BD FACSCanto II and Sysmex XF-1600 in follicular lymphoma progressing to B-lymphoblastic leukaemia/lymphoma.